El átomo
Un átomo es la partícula más pequeña de un elemento que mantiene todas las propiedades de éste. Imaginemos que alguien decide cortar un trozo de aluminio metálico en mitades, sucesivas veces. Al llegar a un punto determinado necesitaría herramientas muy pequeñas para realizar el corte, mucho más pequeñas que cualquiera de las que existen en la realidad. No obstante, si finalmente se pudiera obtener la porción de aluminio más pequeña que conservase todas las propiedades del trozo original, dicha porción sería un átomo de aluminio.
Historia
Una de las cuestiones sobre las que debatían los antiguos pensadores griegos era la estructura de la materia. Se preguntaban si la materia es continua o discontinua. Es decir, en el ejemplo del aluminio mencionado anteriormente, si una persona podría seguir cortando un pedazo de aluminio en trozos más pequeñas de manera indefinida o si, por el contrario, finalmente llegaría a alguna partícula minúscula de aluminio que fuera indivisible.
Dos de los filósofos que argumentaron en favor de la segunda opción fueron Leucipo (nacido hacia 490 a.C.) y su discípulo Demócrito (h. 470 - h. 380). De hecho, fue Demócrito quien utilizó el término atomos por vez primera para describir la partícula de materia más pequeña posible. En griego atomos significa "indivisible".

John Dalton
La teoría de las partículas de materia permaneció sin desarrollar durante más de dos mil años, hasta que en 1808 el químico inglés John Dalton (1766-1844) la replanteó en términos modernos. Dalton consideraba los átomos minúsculas partículas indivisibles, similares a las bolas de cojinetes o a las canicas. La teoría atómica de Dalton explicaba de modo satisfactorio lo que por aquel entonces se conocía de la materia y fue rápidamente aceptada por muchos otros químicos, aunque no por todos.
En los dos siglos transcurridos desde que Dalton propuso por primera vez el concepto moderno de átomo, éste ha experimentado algunos cambios espectaculares. Ya no se piensa que los átomos son partículas indivisibles. Se sabe que se componen de partículas más pequeñas, conocidas como protones, neutrones y electrones. Estas partículas se denominan subatómicas porque son más pequeñas que el propio átomo. Algunas partículas subatómicas pueden dividirse en unidades aún más pequeñas denominadas quarks.
Modelos modernos del átomo
Actualmente los científicos describen los átomos en términos matemáticos: utilizan ecuaciones para representar la probabilidad de encontrar electrones en distintas partes del átomo y para explicar la estructura del núcleo atómico en que se encuentran los protones y los neutrones. Pero a la mayoría de las personas corrientes sigue resultándoles útil considerar los átomos en términos físicos que puedan representarse mentalmente. Para casi todos los fines, estas imágenes son válidas para entender la estructura de los átomos.
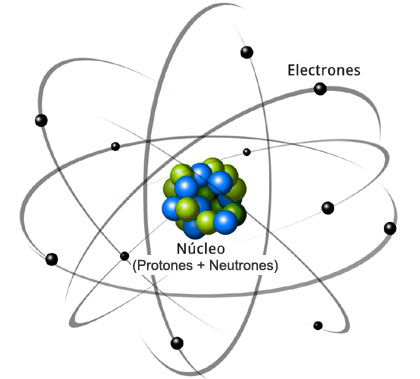
Modelo planetario del átomo
Un átomo consta de dos partes, un núcleo y un conjunto de uno o más electrones que dan vueltas alrededor de él. El núcleo se localiza en el centro del átomo. Contiene uno o más protones y, con excepción del átomo de hidrógeno, uno o más neutrones. El número atómico que cada elemento posee en la tabla periódica indica el número de protones. Un átomo con un protón en su núcleo tiene el número atómico 1 (hidrógeno), mientras que un átomo con dieciséis protones en su núcleo tiene el número atómico 16 (azufre). El número total de protones y de neutrones en un núcleo recibe el nombre de número másico o número de masa del átomo. Un átomo de helio contiene dos protones (su número atómico es 2) y dos neutrones, y por tanto su número de masa es 4.
El número de electrones situado en el exterior del núcleo de un átomo siempre es el mismo que el número de protones. Un átomo con siete protones en su núcleo (no importa cuántos neutrones tenga) también tiene siete electrones fuera de él. Estos electrones se mueven siguiendo trayectorias alrededor del núcleo, que son similares a las órbitas que describen los planetas alrededor del Sol. Cada una de estas órbitas puede albergar un número determinado de electrones. La primera órbita, por ejemplo, puede tener hasta dos electrones, pero no más. La segunda órbita puede albergar hasta ocho electrones, y la tercera órbita puede tener un máximo de dieciocho electrones.
Estos límites determinan la distribución de los electrones en un átomo. Por ejemplo, el núcleo de un átomo de flúor contiene nueve protones, y, por lo tanto también posee nueve electrones en el exterior del núcleo. Dos de estos nueve electrones ocuparán la primera órbita alrededor del núcleo, pero los siete restantes deben situarse en la segunda.
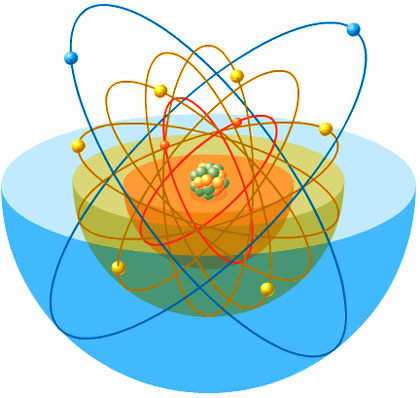
Los electrones orbitan alrededor del núcleo en distintos niveles
En realidad resulta poco riguroso hablar de «órbita», pero el término suele emplearse para ayudar a entender cómo es la trayectoria que describe el electrón. Un término mejor es el de nivel de energía del electrón. Cuanto más cerca está un electrón del núcleo del átomo, menor es su energía; cuanto más lejos del núcleo se encuentra, mayor es la energía que posee. De igual modo que cada nivel puede albergar un número máximo de electrones, existe un máximo de siete niveles en que pueden ubicarse.
Masa y dimensiones del átomo
La masa de protones, neutrones y electrones es tan pequeña que las unidades normales de medida (como el gramo) no se utilizan. Por ejemplo, la masa real de un protón es de 1,6753 x 10-24 gramos. Resulta tan incómodo trabajar con un número de estas características que los científicos crearon una unidad especial conocida como unidad de masa atómica (se designa mediante el símbolo u) para establecer la masa de las partículas subatómicas. Una unidad de masa atómica (1 u) es aproximadamente igual a la masa de un solo protón. Empleando esta medida, la masa de un neutrón también es aproximadamente de 1 u, y la masa de un electrón de alrededor de 0,00055 u.
La masa de un átomo es igual a la suma de la masa de todos los protones, neutrones y electrones. En el caso del átomo de oxígeno (número atómico 8), su masa total es el resultado de sumar la de ocho protones, ocho neutrones y ocho electrones: 8 u + 8 u + (8 x 0,00055 u) = 16,0044 u. Las masa de un átomo se denomina masa atómica o peso atómico. Como puede verse, la masa de un átomo depende principalmente de la masa de sus protones y neutrones, y apenas es afectada por la masa de sus electrones. Obviamente, si se utilizasen las unidades habituales de medida, la masa y el tamaño reales de los átomos también sería incómodamente pequeña. La masa de un átomo de oxígeno medida en gramos resulta ser de 5,36 x 10-23 gramos.
Las dimensiones de un átomo y de su núcleo también son asombrosamente pequeñas. Un átomo típico mide aproximadamente 10-10 metros; pero su núcleo es todavía muchísimo más diminuto: mide alrededor de 10-15 metros. En otras palabras, un átomo tiene un tamaño aproximadamente 100.000 veces más grande que el de su núcleo. Para hacernos una idea de esta comparación, imaginemos un guisante colocado en el centro de un gran estadio de fútbol. Si el guisante representa al núcleo de un átomo, los electrones más cercanos a él girarían a su alrededor más allá de los últimos asientos de la parte más alta del estadio.
Cómo citar este artículo:
Tomás Fernández y Elena Tamaro. «» [Internet].
Barcelona, España: Editorial Biografías y Vidas, 2004. Disponible en
[página consultada el ].

 Editorial Biografías y Vidas
Editorial Biografías y Vidas