La tabla periódica de los elementos
Ideada de forma independiente y simultánea por el químico ruso Dmitri Mendeléyev y el alemán Julius Lothar Meyer, la tabla periódica de los elementos químicos es una de las grandes aportaciones de la química decimonónica. Su fundamento es la llamada «ley periódica»: las propiedades de los elementos varían gradualmente y se repiten periódicamente conforme aumenta su número atómico.
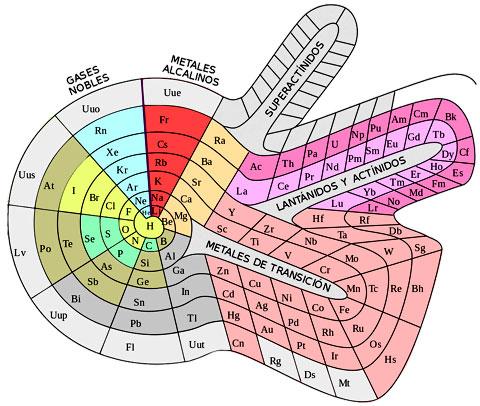
Diseño en espiral de la tabla periódica, obra de Theodor Benfey (1960)
La tabla periódica representa gráficamente esta ley ordenando los elementos en siete filas, de modo que las columnas resultantes agrupan los elementos con propiedades similares. Como ya Mendeléyev demostró en su época, la posición de un elemento en la tabla revela aspectos clave de su naturaleza; el científico ruso predijo que las casillas por aquel entonces vacías correspondían a elementos desconocidos, y estableció con total exactitud sus propiedades antes de su descubrimiento.
Historia de la tabla periódica
A finales del siglo XVIII, la química moderna quedó definitivamente consolidada gracias a la labor de Antoine Lavoisier, que estableció los principios y conceptos fundamentales de esta ciencia a partir de la sistematización e interpretación de los dispersos conocimientos existentes. Entre tales conceptos cabe destacar los de elemento (sustancia que no puede descomponerse mediante procesos químicos) y compuesto (sustancia formada por elementos). El propio Lavoisier, apoyándose en un experimento de Henry Cavendish, había demostrado en 1783 que el agua, considerada uno de los cuatro «elementos» desde la Antigüedad, era en realidad un compuesto de hidrógeno y oxígeno, y en uno de sus textos fundamentales, el Método de nomenclatura química (1787), incluyó ya un total de treinta elementos.

Henry Moseley
A partir de ese momento, la correcta clasificación de la sustancias en elementos y compuestos y la búsqueda de nuevos elementos fue una de las líneas principales de la investigación química; a mediados del siglo XIX, los elementos conocidos sobrepasaban ya la cincuentena. Al mismo tiempo, muchos estudiosos observaron ciertas afinidades entre las propiedades de los elementos y, más allá de las meras listas alfabéticas, intentaron extraer de su análisis criterios de ordenación y clasificación que permitiesen dar cuenta de las semejanzas, diferencias y relaciones entre ellos, en busca de claves que dieran sentido a aquella desordenada variedad.
Ciertas correlaciones en el peso atómico y las propiedades de algunos grupos de tres y de ocho elementos llevaron a algunas tentativas fallidas: las Tríadas de Johann Döbereiner (1829) y las Octavas de John Newlands (1864) eran observaciones certeras, pero no podían aplicarse a todos los elementos. Pero alrededor de 1869, dos químicos realizaron casi el mismo descubrimiento y prácticamente al mismo tiempo. El ruso Dmitri Mendeléyev y el alemán Julius Lothar Meyer sugirieron la idea de ordenar en una tabla todos los elementos de acuerdo con sus respectivos pesos atómicos; de esa manera, las propiedades de los elementos parecían repetirse según una pauta regular.
Sin negar la meritoria aportación de Meyer, en la actualidad tiende a atribuirse a Mendeléyev la creación de la tabla periódica, fundamentalmente porque su versión era más simple y completa. Al disponer todos los elementos en una tabla se producían algunas incongruencias y quedaban sitios vacíos, pero Mendeléyev, en lugar de dudar de la validez del criterio, supuso que se debían a errores de medición del peso atómico, y que los vacíos correspondían a elementos aún no conocidos. De hecho, yendo todavía más lejos, Mendeléyev predijo las propiedades de aquellos elementos desconocidos partiendo del lugar que habían de ocupar en la tabla periódica. Y ciertamente, en menos de una década desde el enunciado de la ley periódica, se descubrieron tres de los elementos cuya existencia había anticipado.

Dmitri Mendeléyev
Aunque los sucesivos descubrimientos de nuevos elementos confirmaban su validez y llevaron a su aceptación universal, durante muchos años subsistieron en la tabla periódica de Mendeléyev unas pocas irregularidades relativas a la posición de ciertos pares de elementos (argón-potasio, cobalto-níquel, telurio-yodo). Correspondió al físico inglés Henry Moseley culminar la genial aportación de Mendeléyev al descubrir (1913), tras complejas investigaciones, que la posición que los elementos ocupaban en la tabla estaba íntimamente relacionada con la carga eléctrica del núcleo, y que tales anomalías se resolvían ordenando los elementos no por el peso atómico, sino por el número atómico.
Como es sabido, un átomo se compone de un núcleo a cuyo alrededor giran una serie de electrones con carga negativa; el núcleo se compone de neutrones (sin carga) y protones (con carga positiva). El número atómico es el número de protones que contiene el núcleo, el cual es igual al número de electrones; de ahí que el átomo sea eléctricamente neutro. Naturalmente, existe una proporcionalidad entre el número de protones de un átomo y su masa, pero no es exacta (el peso atómico incluye los neutrones del núcleo), y de tal inexactitud procedían las anomalías detectadas.
Ordenación y presentación
En la tabla periódica actual, recogiendo el descubrimiento de Moseley, los elementos se ordenan por su número atómico. Si leemos la tabla como un libro, es decir, de izquierda a derecha y por líneas, encontramos en la primera fila el hidrógeno (número atómico 1), y al otro extremo, tras un amplio espacio en blanco, el helio (número atómico 2). Pasando a la segunda fila encontramos el litio y el berilio (3 y 4), y, después de otro espacio en blanco, desde el boro hasta el neón (del 5 al 10). Lo mismo ocurre en la tercera fila, y a partir de la cuarta observamos ya sin espacios una sucesión de elementos ordenados por su número atómico.
En casi todas las ediciones, la tabla periódica de los elementos parece tener la forma de un rectángulo de proporciones semejantes a las de una hoja de papel apaisada. En realidad, es casi el doble de ancha en su representación estricta, que no se emplea porque para su impresión se necesitaría un papel muy alargado, de proporciones que desbordarían todos los formatos habituales. Las dos filas de elementos de la parte inferior, que parecen quedar al margen, se sitúan en realidad en el interior de las filas sexta y séptima de la tabla.
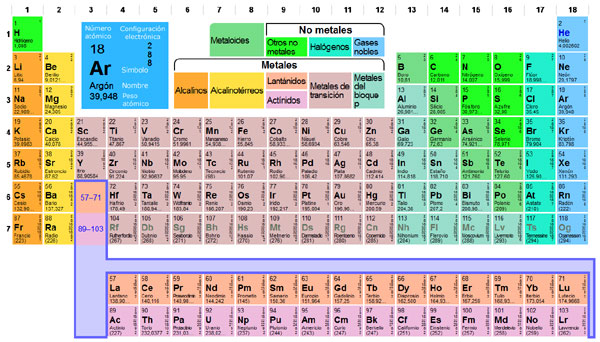
Tabla periódica (clic para ampliar)
Así, en la sexta fila, a continuación del lantano (número atómico 57), deberían situarse los elementos de la primera fila al margen, llamados lantánidos: desde el cerio (58) hasta el lutecio (71). Ello explica el salto observable en la sexta fila, que pasa de pronto del lantano (57) al hafnio (72). Del mismo modo, en la séptima fila, y a continuación del actinio (89), deberían encontrarse los actínidos (del 90 al 103), representados en la segunda fila al margen. Lantánidos y actínidos constituyen los elementos llamados de doble transición o tierras raras.
Símbolos empleados
Cada casilla de la tabla corresponde a un elemento; la información relativa al elemento contenida en cada casilla varía según los ediciones y el público al que van destinadas (desde niños hasta estudiantes universitarios y profesionales), pero normalmente se incluyen al menos cuatro datos básicos. En primer lugar, destacado, el símbolo del elemento, formado a partir de la abreviatura de su nombre en lenguas que pueden divergir de la nuestra. Los elementos ya conocidos en la Antigüedad, por ejemplo, se designan en latín, y de ahí que el símbolo del hierro sea Fe (del latín ferrum). Debajo del símbolo suele figurar el nombre del elemento en la lengua del receptor.
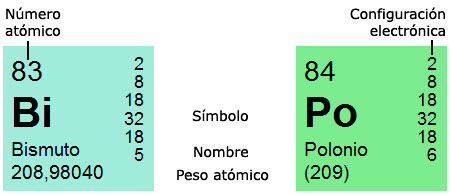
En la parte superior izquierda se indica el número atómico, es decir, el número de protones que contiene el núcleo del átomo del elemento. En ocasiones, la parte superior derecha contiene una columna de números: es la configuración electrónica o distribución de los electrones en los distintos niveles energéticos, que examinaremos luego con más detalle. La suma de los números de esta columna es igual al número atómico, puesto que, como ya se ha explicado, el número de electrones es igual al número de protones.
En la parte inferior, por último, suele indicarse el peso atómico; si va entre paréntesis, corresponde al del isótopo más estable. Los colores de fondo de cada casilla se emplean con finalidades diversas; pueden, por ejemplo, significar el estado (sólido, líquido, gaseoso) o la pertenencia a diversos grupos: alcalinos, alcalinotérreos, metales de transición, etc.
Periodos y grupos
«Leer» la tabla como un libro, de izquierda a derecha y por líneas, equivale a leer sus filas o periodos. Los periodos son siete (y no nueve, pues, como se ha visto, las dos filas al margen de la parte inferior pertenecen en realidad a los períodos sexto y séptimo). Siguiendo este modo de lectura, encontramos los elementos ordenados por su número atómico, lo que significa que, conforme avanzamos, aumenta el número de protones y de electrones, y con ello la complejidad de su configuración electrónica.
También aumenta la inestabilidad de los núcleos; elementos de elevado número atómico como el uranio sufren una transformación lenta y continua por vía de emisión de radiaciones (radiactividad), convirtiéndose con el tiempo en otros elementos de número atómico inferior. Todos los elementos con número atómico superior al del uranio (92), llamados transuránicos, son radiactivos y han sido obtenidos artificialmente en los laboratorios.
Naturalmente, y éste es el sentido de una tabla, también podemos «leer» de arriba abajo las columnas de elementos. Las columnas (en total dieciocho) son grupos o familias de elementos. La numeración de estos dieciocho grupos puede variar. El sistema que emplea números romanos y letras (IA) se ha usado tradicionalmente en Estados Unidos; el otro sistema (1, 2, 3, 4, etc.) se ha usado tradicionalmente en Europa y hace unos años se recomendó su uso también en Estados Unidos.

Tabla periódica en versión alargada (clic para ampliar)
La llamada ley periódica es el fundamento de la tabla, y puede formularse así: las propiedades de los elementos son una función periódica de su número atómico, es decir, tienden a variar gradualmente y a repetirse periódicamente conforme se incrementa el número atómico. En otras palabras, los elementos químicos de la misma fila o periodo tienen propiedades que cambian lentamente de un extremo de la fila al otro, y los del mismo grupo o columna tienden a tener propiedades químicas similares.
En este sentido, la tabla periódica no es más que una manera gráfica de representar la ley periódica. Pero precisamente por presentar de modo visual las relaciones recíprocas entre los elementos, es una herramienta sumamente práctica y poderosa: sabiendo solamente qué lugar de la tabla ocupa un elemento, se puede conocer mucho acerca de sus propiedades físicas y químicas, como ya Mendeléyev demostró en su tiempo.
Periodos y configuración electrónica
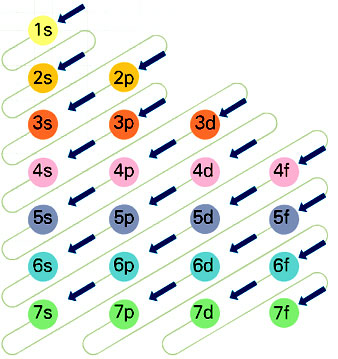
En una primera aproximación resulta un tanto extraña la irregular distribución de los elementos: un primera fila con solamente dos, después filas de ocho, y luego de dieciocho hasta llegar a filas de 32 elementos. Tal distribución viene determinada por la afinidad de propiedades que presentan los elementos de cada columna. Tras el desarrollo del modelo atómico de Niels Bohr (1913), fue posible explicar con mayor claridad las peculiaridades de esta distribución.
Los átomos constan de un núcleo a cuyo alrededor gira un conjunto de electrones. El número de electrones (partículas con carga negativa) que forma esa «nube electrónica» es igual al número de protones (partículas con carga positiva) que contiene el núcleo, y viene indicado en el número atómico. Así, que el hierro tenga el 26 como número atómico significa que el núcleo de un átomo de hierro posee 26 protones, y que otros tantos 26 electrones orbitan alrededor del núcleo.
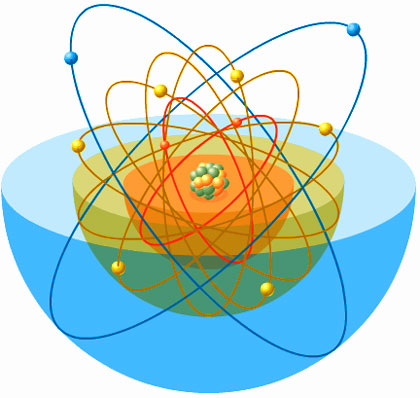
Los electrones orbitan alrededor del núcleo en distintas capas o niveles
Sin embargo, existe solamente un total de siete capas o niveles en los que los electrones pueden orbitar, y estas siete capas corresponden a los siete periodos o filas de la tabla periódica. Los elementos del primer periodo o fila (el hidrógeno y el helio) tienen un único nivel. Los elementos pertenecientes al segundo periodo poseen dos niveles; los del tercero, tres, y así hasta los del séptimo y último periodo, que poseen siete. De este modo, por el número atómico y por su pertenencia al cuarto periodo, sabemos que los 26 electrones del hierro se distribuyen en cuatro niveles.
La distribución de los electrones por los distintos niveles obedece a una serie de reglas y principios como el principio de exclusión de Pauli, el principio de mínima energía (los electrones se distribuyen ocupando, en primer lugar, los orbitales de menor energía) y la regla de Hund (los electrones que ocupan un orbital de la misma energía se hallan desapareados al máximo). El principio de Hund y el de mínima energía tienen algunas excepciones, aunque pocas, debido a las energías muy próximas de algunos orbitales externos.
De este modo, que el primer periodo de la tabla contenga solamente dos elementos (el hidrógeno y el helio) refleja el hecho de que, por lo que respecta a la distribución de los electrones, el primer nivel de todos los átomos puede contener un máximo de dos electrones. Los dos elementos del primer periodo, el hidrógeno y el helio, poseen respectivamente uno y dos electrones en su único nivel. Del mismo modo, el segundo nivel puede contener un máximo de ocho electrones, y el segundo periodo contiene ocho elementos, desde el litio (número atómico 3), con dos electrones en el primer nivel y uno en el segundo, hasta el neón (número atómico 10), con dos electrones en el primer nivel y ocho en el segundo. Aunque simplificada (pues no contempla el hecho de que cada una de las siete capas o niveles puede incluir varios orbitales), la explicación anterior permite comprender la extraña forma de la tabla periódica.
Los electrones se distribuyen ocupando primero los orbitales de menor energía
La distribución de los electrones por los distintos niveles y orbitales recibe el nombre de configuración electrónica. Las ediciones más detalladas de la tabla periódica indican la configuración electrónica mediante una terminología abreviada. En la más simple se indica solamente la cantidad de electrones de cada nivel, sobreentendiéndose que el primer número corresponde al primer nivel, el segundo al segundo, etc. La configuración electrónica del oxígeno (número atómico 8), por ejemplo, se expresa simplemente 2 6 (poniendo los números en columna), lo que significa que el oxígeno posee dos electrones en el primer nivel y seis en el segundo.
Las ediciones profesionales de la tabla detallan la distribución de los electrones en los distintos orbitales de cada nivel mediante una notación más precisa; en ella, los números corresponden a los niveles, las letras a los orbitales de cada nivel y los superíndices al número de electrones en cada orbital. En esta notación, la configuración electrónica del oxígeno quedaría así:
1s2 2s2 2p4
Lo cual significa que, de los ocho electrones del oxígeno, dos completan el primer nivel (1) y los seis restantes ocupan el segundo (2), repartidos entre un orbital s (con dos electrones) y un orbital p (con cuatro electrones).
Grupos y valencias
Como ya se ha indicado, los elementos de una misma columna poseen propiedades parecidas, y constituyen grupos o familias de elementos. También la razón de esta semejanza se comprende mejor acudiendo a la configuración electrónica. De hecho, fue precisamente la tabla periódica y el refinamiento del modelo atómico lo que permitió inferir que el comportamiento químico de los elementos depende principalmente del último nivel de electrones, es decir, de la capa de electrones más alejada del núcleo.
La actividad química y la afinidad entre los elementos, en efecto, se explica por la tendencia de los átomos a fijar ocho electrones, ni más ni menos, en su capa externa, ora perdiendo, ora captando electrones. Los metales (cuyos átomos tienen uno, dos o tres electrones en su nivel externo) los ceden fácilmente para convertir en periférica la penúltima capa de ocho electrones. En cambio, los átomos de cinco, seis y siete electrones exteriores captan con facilidad tres, dos o un electrón, respectivamente, con objeto de completar a ocho su periferia. El número de electrones periféricos o su complemento a ocho constituye la valencia química.
 En consecuencia, los átomos pueden combinarse entre sí de dos modos: por electrovalencia y por covalencia. En la electrovalencia o unión polar, los átomos de uno, dos o tres electrones periféricos ceden éstos a otros átomos con siete, seis o cinco electrones en la capa externa, con lo cual las periferias de unos y otros quedan establecidas en ocho electrones; como el intercambio de electrones implica la ionización con signo opuesto de los átomos que reaccionan, éstos quedan unidos entre sí por atracción electrostática. En el enlace covalente, los átomos con cuatro electrones externos no toman ni ceden electrones, sino que los comparten con los de otros elementos, formando pares o dobletes electrónicos. Esta unión es más estable que la polar.
En consecuencia, los átomos pueden combinarse entre sí de dos modos: por electrovalencia y por covalencia. En la electrovalencia o unión polar, los átomos de uno, dos o tres electrones periféricos ceden éstos a otros átomos con siete, seis o cinco electrones en la capa externa, con lo cual las periferias de unos y otros quedan establecidas en ocho electrones; como el intercambio de electrones implica la ionización con signo opuesto de los átomos que reaccionan, éstos quedan unidos entre sí por atracción electrostática. En el enlace covalente, los átomos con cuatro electrones externos no toman ni ceden electrones, sino que los comparten con los de otros elementos, formando pares o dobletes electrónicos. Esta unión es más estable que la polar.
Visto lo anterior, es fácil comprender la razón por la que los elementos situados en la misma columna forman grupos o familias de propiedades muy parecidas: al ordenarlos por el número atómico (numero de protones y por tanto de electrones), se repite periódicamente el número de electrones contenidos en la última capa, y tal número es, conforme a lo expuesto, lo que determina el modo en que reaccionan químicamente los átomos.
Así, los elementos del primer grupo o columna (del hidrógeno al francio) tienen un único electrón en su capa externa, y los del segundo grupo, dos, como puede notarse en la imagen: el último número de la configuración electrónica siempre es 1 en el primer grupo y 2 en el segundo. Los elementos de las columnas 13, 14, 15, 16 y 17 poseen, respectivamente, 3, 4, 5, 6 y 7 electrones en su nivel externo. Los elementos de la última columna (18), del helio al radón, tienen completada su capa exterior con 8 electrones (excepto el helio, cuya única capa se completa con dos), y por este motivo raramente participan en las reacciones químicas: son los llamados «gases nobles», que, al igual que los aristócratas, tienden a no mezclarse con los elementos «plebeyos».
Hay que advertir que de nuevo esta explicación es una reducción didáctica destinada a mostrar el sentido general de la tabla. Su exactitud puede apreciarse en las columnas citadas, y requeriría aclaraciones adicionales en los llamados metales de transición (columnas 3-12).
Elementos ignotos
Actualmente se conocen 118 elementos, que van del hidrógeno, cuyos átomos tienen un solo electrón, hasta unos pocos elementos todavía sin nombre definitivo cuyos átomos poseen más de 112 electrones. Normalmente las tablas contienen los elementos conocidos en el momento de su edición, aunque en ocasiones, emulando la osadía de su creador, se incluyen casillas para aquellos cuyo descubrimiento, se supone, es solamente cuestión de tiempo.
De hecho, data de fechas cercanas el descubrimiento de diversos elementos «superpesados» como el darmstadio (número atómico 110) y el roentgenio (111), obtenidos ambos a finales de 1994 por un equipo internacional de científicos. El darmstadio se logró haciendo chocar átomos de níquel con un isótopo de plomo; los investigadores de Rusia tienen planes para producir un isótopo diferente de este elemento mediante el choque de átomos de azufre con átomos de plutonio. En un laboratorio de California se descubrieron recientemente los elementos 116 y 118.
A causa de su inestabilidad, la vida de este tipo de elementos es muy corta: se descomponen en fracciones de segundo, lo que no impide que puedan detectarse durante ese breve instante, confirmando así su existencia. Todavía no se ha logrado producir otros elementos superpesados, pero se continúa investigando para obtenerlos. En realidad, quedan muchos descubrimientos interesantes por hacer en relación con la producción artificial de nuevos elementos; con la tabla periódica como guía, su lugar ya los está esperando.
Cómo citar este artículo:
Tomás Fernández y Elena Tamaro. «» [Internet].
Barcelona, España: Editorial Biografías y Vidas, 2004. Disponible en
[página consultada el ].

 Editorial Biografías y Vidas
Editorial Biografías y Vidas